Електронна формула сульфуру: основи і практична реалізація
Електронна формула сульфуру є важливим аспектом вивчення його хімічних та фізико-хімічних властивостей. Розуміння розташування електронів у атомі сульфуру допомагає зрозуміти як він взаємодіє з іншими елементами, створюючи різноманітні сполуки.
Розуміння електронної формули
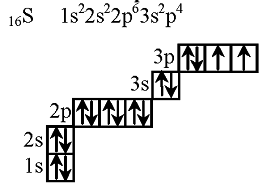
Сульфур (S) має порядковий номер 16, що означає наявність 16 електронів у нейтральному атомі. З метою розподілу електронів використовується принцип найлегшого розташування з енергетичності орбіталей від нижчих до вищих.
| Електронна оболонка | Електронна конфігурація |
|---|---|
| 1s | 2 електрони |
| 2s | 2 електрони |
| 2p | 6 електронів |
| 3s | 2 електрони |
| 3p | 4 електрони |
Отже, електронна формула сульфуру виглядає так: 1s2 2s2 2p6 3s2 3p4.
Виділення валентних та внутрішніх електронів
- Внутрішні електрони: Вони присутні у заповнених 1s, 2s та 2p орбіталях. Ці електрони не беруть участі в утворенні хімічних зв’язків.
- Валентні електрони: Лише електрони у 3s та 3p орбіталях, загалом 6 електронів, беруть участь у хімічних реакціях такі, як утворення зв’язків із сусідніми атомами.
Застосування електронної формули сульфуру
Електронна формула сульфуру допомагає визначити його хімічні особливості, передбачаючи стабільність ймовірних сполук. Ось кілька конкретних застосувань:
- Оксиди сульфуру: Завдяки наявності валентних електронів, сульфур утворює різні оксиди, такі як SO2 та SO3.
- Сульфідні сполуки: Реакція з металами веде до утворення сульфідів, наприклад FeS.
- Вплив на біологію: Сульфур є важливим для живих організмів і входить до складу амінокислот (наприклад, цистеїну), які забезпечують важливі функції в організмі.
Узагальнення
Електронна формула сульфуру залишається базовим інструментом як для науковців, так і для освітян, щоб краще зрозуміти поведінку цього елемента в природі. Подальше вивчення цієї формули дозволяє відкрити нові перспективи в хімічних дослідженнях і вдосконалити технології, засновані на хімічних з’єднаннях сульфуру.